127# الوحدة 4 الأحماض والأسس، المعايرة phمترية، نسبة التقدم النهائية 𝜏𝑓، بيان بشكل جديد
Автор: الأستاذ طواهرية عبد العزيز
Загружено: 2020-08-02
Просмотров: 10052
الأستاذ طواهرية عبد العزيز أستاذ العلوم الفيزيائية
🔔 فعل الجرس لكي يصلك الفيديو عند نشره 🔔
تحميل سلسلة التمارين بصيغة pdf من هنا:
https://2u.pw/z0NIi
نص التمارين:
نحل كمية كتلتها 𝑚=0,046 g من حمض الميثانويك في الماء المقطر، فنحصل على محلول حجمه 𝑉=100 𝑚𝐿 وناقليته النوعية 𝜎=0,049 𝑆.𝑚^(−1).
1- أحسب 𝑝𝐻 المحلول.
2- بين أن النسبة النهائية للتقدم تكتب على الشكل:
𝜏_𝑓=𝐾_𝐴/(𝐾_𝐴+10^(−𝑝𝐻) )
ثم احسب قيمتها، ماذا تستنتج؟
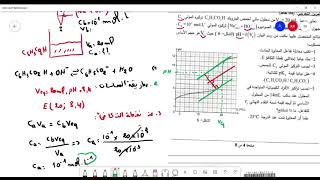
3- نعاير حجما 𝑉_𝐴=10 𝑚𝐿 من المحلول السابق بمحلول هيدروكسيد الصوديوم (〖𝑁𝑎〗^+,〖𝑂𝐻〗^− ) تركيزه المولي 𝐶_𝐵. نمثل في الشكل 1 البيان log〖([〖𝐻𝐶𝑂𝑂〗^− ]/[𝐻𝐶𝑂𝑂𝐻] )=𝑓(𝑉_𝐵 )〗.
4-أ- اكتب معادلة التفاعل.
ب- أوجد حجم التكافؤ، ثم احسب 𝐶_𝐵.
جـ- احسب قيمة 𝑝𝐻 المزيج عند التكافؤ.
المعطيات:
λ_(𝐻_3 𝑂^+ )=35 (𝑚𝑆.𝑚^(−1).〖𝑚𝑜𝑙〗^(−1))
𝜆_(〖𝐻𝐶𝑂〗_2^− )=5,46 (𝑚𝑆.𝑚^(−1).〖𝑚𝑜𝑙〗^(−1))
للمزيد زوروا موقعنا على الرابط التالي:
https://www.touahria.com/
تابعونا على صفحتنا الرسمية على الرابط التالي:
/ prof.touahria.abdelaziz

Доступные форматы для скачивания:
Скачать видео mp4
-
Информация по загрузке: